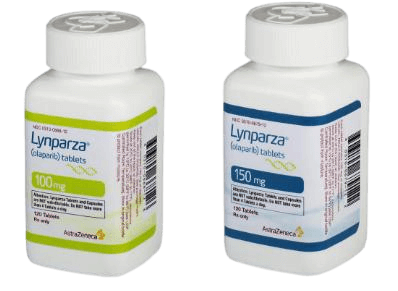
Lynparza(olaparib)获得美国FDA批准,用于治疗BRCA突变的前列腺癌
2023年5月31日,美国食品和药物管理局(FDA)确实批准了Lynparza(奥拉帕利)与阿比特龙(Zytiga)和泼尼松龙(或泼尼松)联合使用,作为治疗经FDA批准的伴随诊断试验检测出有害或疑似有害BRCA突变的转移性去势抵抗性前列腺癌(mCRPC)患者的疗法。
2023年12月26日