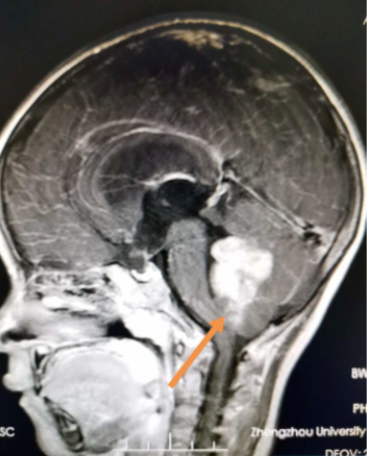
髓母细胞瘤(medulloblastoma,MB)是儿童常见的颅内恶性肿瘤,其细胞形态类似胚胎期髓母细胞,故以此命名。MB约占儿童期中枢神经系统肿瘤的20%,发病率为0.2~0.58/10万人,男性略多于女性。髓母细胞瘤存在两个发病高峰,分别为3~4岁和8~10岁。髓母细胞瘤占颅内肿瘤7-8%,占儿童颅内肿瘤30%,我国每年新发病例6000-7000例,是严重威胁广大儿童生命健康的中枢神经系统疾病。图源:https://www.meipian.cn/2lvar1sy绝大多数髓母细胞瘤为散发病例,不到5%的髓母细胞瘤患儿与家族性遗传性疾病相关,包括家族性腺瘤性息肉病(familial adenomatous polyposis,FAP),痣样基底细胞癌综合征(nevoid basal cell carcinoma syndrome,NBCCS)。髓母细胞瘤起源于小脑或者脑干,容易发生经脑脊液播散转移。- 颅高压表现:约80%髓母细胞瘤发生于第四脑室区域,肿瘤生长可引起第四脑室和中脑导水管受压,导致梗阻性脑积水形成引起颅内压增高,表现为头痛、呕吐、视物模糊,甚至意识改变等。
- 其他:颅神经受压引起的复视,小脑或者脑干受压引起的眩晕,肿瘤压迫延髓可表现为吞咽发呛和锥体束征,脊髓转移病灶可引起截瘫。
术前影像学表现结合术后病理诊断可以确诊髓母细胞瘤。- M2期: 小脑蛛网膜下腔及(或)侧脑室或第三脑室肉眼可见结节状种植;- 根据年龄、手术切除程度、有无转移、病理类型,分为标危组和高危组。
- 标危组:术后肿瘤残余<1.5 cm2,Chang氏分期M0。同时满足以上2个条件。- 高危组:术后肿瘤残余≥1.5 cm2;脑脊液肿瘤细胞学检查阳性,或头部或脊髓检查存在肿瘤播散证据,或颅外转移;病理组织学弥漫间变型。满足以上任一条件者,归为高危组。- 标危组:肿瘤残余病灶<1.5 cm2;Chang氏分期M0;病理类型为促纤维增生结节型或者广泛结节型。同时满足以上3个条件。- - 低危组:未发生播散的WNT型髓母细胞瘤,年龄<16岁;Group4型,伴有11号染色体缺失或者17号染色体重复,同时未发生转移者被纳入本组。五年生存率>90%。- 标危组:未发生播散的TP53野生型且无MYCN扩增的SHH型;无MYC扩增的Group3;无11号染色体丢失的Group4纳入本组。五年生存率为75%~90%。- 高危组:发生播散的Group4型;发生播散的非婴儿型TP53野生型SHH型;未播散的MYCN扩增的SHH型纳入本组。五年生存率50%~75%。
- 极高危组:TP53突变的SHH型;发生播散的MYC扩增的Group3型纳入本组。五年生存率<50%。本规范重点参考COG、SIOP方案和CCCG方案,提供的以下治疗方案各医院根据各自情况选择应用,部分患者可结合所在医院实际情况适当改良。- 手术治疗的目的是尽可能安全地最大程度切除肿瘤、明确诊断、重建脑脊液循环。手术治疗的原则是在保证不损害正常脑组织的前提下实现肿瘤的最大切除。手术入路多采用后正中入路或者旁正中入路。如果术中发现肿瘤已经侵及脑干,则不应该盲目追求全切,否则导致严重的不良后果。手术的切除程度和患儿的预后相关,术后肿瘤残余面积大于1.5 cm2,其预后通常较差,为危险因素之一。尽可能在术后72 h内行头MR检查评价肿瘤切除程度。
- 不建议术前行脑室腹腔分流手术。如果患儿术后或者在放化疗过程中出现了脑室扩大,颅高压表现,且不能缓解,可行脑室腹腔分流术,重建脑脊液循环平衡。
手术后应该尽快开始放疗治疗。建议在术后4周内开始放疗,延迟放疗与不良预后相关,晚于49天放疗患儿预后明显不佳。放疗期间可每周给与长春新碱。<3岁标危患者不放疗,<3岁高危患者延迟至3岁后放疗或化疗后行局部临床放疗或姑息放疗。>3岁放疗剂量及范围如下:- 全脑全脊髓放疗23.4~24Gy(未来有望减少到18 Gy),后颅窝加强放疗54~55 Gy,或者范围为包括瘤床边缘1~2 cm,剂量为30.6 Gy。
- 后颅窝54~55.9 Gy,全脑全脊髓放疗36~39.6 Gy,对于脊髓结节转移灶,给予50.4 Gy的加强放疗。
- 放疗结束4周后开始辅助化疗。化疗方案为洛莫司汀+顺铂+长春新碱方案,共8个疗程。或者环磷酰胺+顺铂+长春新碱方案,共8个疗程。
- 手术后2~4周开始辅助化疗,化疗方案为环磷酰胺+长春新碱/大剂量甲氨蝶呤/卡铂+依托泊苷交替化疗,共12个疗程。高剂量化疗联合干细胞挽救治疗。高危患者如条件许可,可行自体造血干细胞支持下超大剂量化疗。
质子治疗(proton therapy,PT)是一种可用于治疗髓母细胞瘤的放疗技术,它是使用质子射线通过高能加速器变成高能量质子,从体外对病灶处进行照射,摧毁肿瘤。传统放射线治疗由于在人体浅表处剂量高,可以穿透人体,并且照射面积广,因此它对健康组织有很高的致癌风险。质子治疗可降低这种致癌风险,当肿瘤直接与重要器官相邻时,质子治疗不仅可以杀死肿瘤,还可以保护这些器官的功能,这在传统放疗中是不可能实现的。有数据显示,传统放疗(X线)对儿科肿瘤来说,出现由放射导致的二次肿瘤的风险高达30%,质子在肿瘤外部所释放的放射源以及二次癌症的可能性被降低,这对儿童来讲是十分重要的,也是关系到患者生存质量的重要因素。
质子治疗很大程度上避免了对髓母细胞瘤儿童患者的心脏、肺、腹部和食道的辐射,极大的降低了治疗造成的副作用,这大大降低了治疗对患者产生长期不利影响的可能性。研究表明,采用质子治疗控制儿童肿瘤效果显著。照射剂量远远低于传统放疗,质子治疗不但避免了对处于生长期的器官和组织的损伤,又降低了病发性癌症的发生。接受脑瘤治疗的儿童通常会受到放射治疗的显著长期影响。即使是小剂量的辐射也会导致记忆力和智力下降,还会损伤下丘脑和脑垂体,而下丘脑和脑垂体会产生或引导许多必需激素的产生,比如生长激素、甲状腺激素、生殖激素、可的松和性激素等。中等剂量或与一些化疗药物联合使用,会导致听力损失和其他并发症。高辐射剂量导致非常严重的缺陷可能性较低,如瘫痪或失明。目前临床研究表明,质子放射治疗髓母细胞瘤疗效确切,可大大降低后颅窝外和脊柱前正常组织器官的受照剂量,减少了正常组织晚期并发症和第2原发癌的发生,取得常规放疗不能达到的良好效果。对于降低儿童髓母细胞瘤放疗过程中的胃肠道反应、造血功能的影响、骨骼成长发育等均有优势。因此,质子治疗强调个性化和综合性的治疗方案。髓母细胞瘤需要先进行手术,然后采用化疗和质子治疗相结合的方案。根据对患儿病情的诊断,治疗过程通常持续四到八周。每次治疗的照射时间仅为一分钟,根据患儿的情况,一次完整的治疗包括准备阶段需要60-90分钟。一些特殊情况需要注射镇静剂以保持患儿在治疗过程中安稳不动,治疗时间可能会延长至90分钟。- 对正常组织细胞的影响极小,与传统放疗相比,副作用小。
 图源:《Neuro-oncology》麻省总医院2000-2016年间178名组织学证实为标准风险(SR)、中等风险(IR)或高风险(HR)髓母细胞瘤并接受PT的儿童患者均被纳入研究。除1人外,其他患者都接受了手术切除原发肿瘤,随后同时进行了PT和/或辅助化疗,患者在手术前后均进行了脑部MRI检查和脑脊液(CSF)细胞学检查。其中102例(57.3%)为SR,76例(42.7%)为IR或HR,患者中位随访时间为9.3年(范围0.5-17.2)。178名患者中,8名患者(4.5%)在中位随访9.1年(4.4-13.3)时出现继发性(良性或恶性)肿瘤,3名患者(1.7%)出现第二恶性肿瘤。任何继发肿瘤、继发恶性肿瘤和继发良性肿瘤的10年累积发病率(CI)分别为5.6%(95%CI:2.2-11.3)、2.1%(95%CI:0.6-5.8)和3.4%(95%CI:0.9-8.9)。4名患者在中位数为4.2年(0.7-11.0)时发生脑干损伤。5年和10年的脑干损伤累积发生率分别为1.1%(95%CI:0.2-3.7)和1.9%(95%CI:0.5-5.1)。这是质子治疗髓母细胞瘤患者规模最大、最成熟的一项队列研究,中位随访时间长达9.3年,研究人员报告了这一人群长期疾病结果、失败模式、预后及继发性肿瘤的发生率,为将PT作为儿童髓母细胞瘤的最佳治疗方案提供了强有力的依据。
图源:《Neuro-oncology》麻省总医院2000-2016年间178名组织学证实为标准风险(SR)、中等风险(IR)或高风险(HR)髓母细胞瘤并接受PT的儿童患者均被纳入研究。除1人外,其他患者都接受了手术切除原发肿瘤,随后同时进行了PT和/或辅助化疗,患者在手术前后均进行了脑部MRI检查和脑脊液(CSF)细胞学检查。其中102例(57.3%)为SR,76例(42.7%)为IR或HR,患者中位随访时间为9.3年(范围0.5-17.2)。178名患者中,8名患者(4.5%)在中位随访9.1年(4.4-13.3)时出现继发性(良性或恶性)肿瘤,3名患者(1.7%)出现第二恶性肿瘤。任何继发肿瘤、继发恶性肿瘤和继发良性肿瘤的10年累积发病率(CI)分别为5.6%(95%CI:2.2-11.3)、2.1%(95%CI:0.6-5.8)和3.4%(95%CI:0.9-8.9)。4名患者在中位数为4.2年(0.7-11.0)时发生脑干损伤。5年和10年的脑干损伤累积发生率分别为1.1%(95%CI:0.2-3.7)和1.9%(95%CI:0.5-5.1)。这是质子治疗髓母细胞瘤患者规模最大、最成熟的一项队列研究,中位随访时间长达9.3年,研究人员报告了这一人群长期疾病结果、失败模式、预后及继发性肿瘤的发生率,为将PT作为儿童髓母细胞瘤的最佳治疗方案提供了强有力的依据。图文参考来源:
[1].儿童髓母细胞瘤诊疗规范(2021年版)[J].全科医学临床与教育,2021,19(07):581-584.DOI:10.13558/j.cnki.issn1672-3686.2021.007.002.
[2]Zhukova N,Ramaswamy V,Remke M,Pfaff E,Shih DJ,Martin DC,Castelo-Branco P,Baskin B,Ray PN,Bouffet E,von Bueren AO,Jones DT,Northcott PA,Kool M,Sturm D,Pugh TJ,Pomeroy SL,Cho YJ,Pietsch T,Gessi M,Rutkowski S,Bognar L, Klekner A,Cho BK,Kim SK,Wang KC,Eberhart CG,Fevre-Montange M,Fouladi M,French PJ,Kros M,Grajkowska WA,Gupta N,Weiss WA,Hauser P,Jabado N,Jouvet A,Jung S,Kumabe T,Lach B,Leonard JR,Rubin JB,Liau LM,Massimi L,Pollack IF,Shin Ra Y,Van Meir EG,Zitterbart K,Schüller U,Hill RM,Lindsey JC,Schwalbe EC,Bailey S,Ellison DW,Hawkins C,Malkin D,Clifford SC,Korshunov A,Pfister S,Taylor MD, Tabori U.Subgroup-specific prognostic implications of TP53 mutation in medulloblastoma.J Clin Oncol.2013 Aug 10;31(23):2927-35.doi:10.1200/JCO.2012.48.5052.Epub 2013 Jul 8.PMID:23835706;PMCID:PMC4878050.
[3]Baliga S,Gallotto S,Bajaj B,Lewy J,Weyman E,Lawell MP,Yeap BY,Ebb DE,Huang M,Caruso P,Perry A,Jones RM,MacDonald SM,Tarbell NJ,Yock TI.Decade-long disease,secondary malignancy,and brainstem injury outcomes in pediatric and young adult medulloblastoma patients treated with proton radiotherapy.Neuro Oncol.2022 Jun 1;24(6):1010-1019.

 图源:《Neuro-oncology》
图源:《Neuro-oncology》