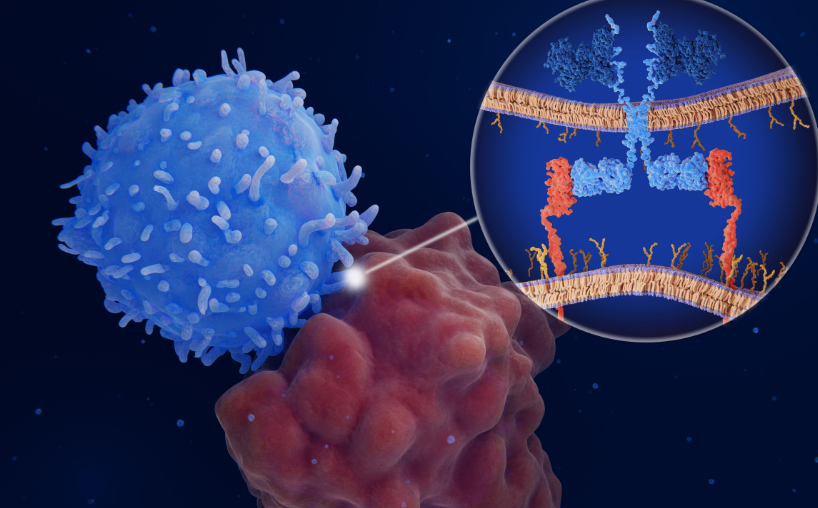
CAR-T细胞治疗是一种新型的癌症治疗方法,近年来成为临床研究的热点和亮点之一。从基础研究到现阶段的治疗开发,已经取得了显著的进展。在CAR-T细胞治疗中,它能帮助我们将患者自己的免疫细胞重编程,令其改变原本的生物功能,从而攻击体内的癌细胞。 T细胞在人体中的作用 T细胞是一种免疫细胞,主要在人体内部发挥着重要的免疫调节作用。它们可以识别和攻击外来异物(如病毒、细菌等)和异常细胞(如肿瘤细胞),从而保护人体免受疾病攻击。 具体而言,T细胞在人体中的作用包括:直接杀死致病细胞、激活和调节其他免疫细胞、调节免疫反应。T细胞在人体内起到了非常重要的免疫调节作用,是维护人体健康的重要组成部分。 什么是CAR-T细胞治疗 CAR-T细胞治疗(Chimeric Antigen Receptor T-cell Therapy)又称人工合成抗原受体T细胞疗法。该技术利用CRISPR/Cas9等方法可改造T细胞,使它能够识别和消灭一些癌细胞,实现癌细胞的有针对性杀死。 CAR-T细胞疗法基于多肽抗原及其特异性重组刺激信号的融合制备。NIAID(美国国立过敏症和传染病研究所)对CAR-T细胞治疗的科普解释是:“CAR-T细胞是在实验室中通过重构受体把一种人的T细胞转变成白血病(癌症)抗体,然后将其重新注入患者的体内来对抗病情。” 研究历程 CAR-T细胞治疗技术已经多年在临床上得到了应用,目前已有不少的文献有所记录。 早在2005年,卡尔·贝恩斯和所在的团队成功地开发制备了最初的CAR-T细胞;2012年,飞利浦(Phillips)等人首次使用CD19特异性的CAR-T细胞治疗患有急性B细胞性白血病(B-ALL)的患儿; 在2017年8月30日,美国FDA批准一款针对一型儿童白血病(ALL)的CAR-T细胞疗法,标志着CAR-T细胞疗法从实验室走向了门诊。不过,这种治疗的应用范围还比较狭窄,主要以血液恶性肿瘤为主。 CAR-T细胞治疗的适应症 截至2020年,CAR-T细胞治疗主要适应于两种类型的血液癌:一是B细胞白血病(B-ALL\B-CLL),另外则是B细胞淋巴瘤。其中,最常见的是急性淋巴细胞白血病。 CAR-T细胞治疗的优势和不足 CAR-T细胞治疗作为一个新型免疫治疗方法,在肿瘤治疗领域中,在一些方面有着显著的优势。它在治疗效果、安全性和患者质量生命等多个方面都相对较好。 但是,在CAR-T细胞治疗中,同样存在一些不足之处如:而最大的不足即是较长的治疗时间和昂贵的治疗成本。 注意事项 关于CAR-T细胞治疗的注意事项,从患者的预防措施和治疗后需要的监护,到治疗的安全、有效性和易发生的副作用等都十分重要。 因此,如何在CAR-T细胞治疗过程中进行科学合理的护理是非常关键的,也是患者和家属最关心的问题之一。 CAR-T细胞治疗的案例 美国一名女婴首例成功吸收CAR-T细胞治疗后进入完全缓解状态。 该女婴生于2016年8月,出生后数周即被确诊为先天性急性淋巴细胞性白血病。两岁时,在接受化学疗法的过程中,该名美国女婴被通知已耐药,这时候其父母便在医生推荐下前往宾夕法尼亚大学进行CAR-T细胞治疗。 医生们收集和选取了符合条件的T细胞,并对其进行基因工程引导其攻击靶细胞。经过一年多的治疗,她于2021年底进入最终清除阶段。 总之,CAR-T细胞治疗在靶向治疗方面已经展现了明显的优势,为血液肿瘤患者带来了新的治疗选择。截至目前,CAR-T细胞疗法在美国已获得美国FDA批准,而如今它也正在逐步进入世界各地的医疗系统。然而要实现CAR-T细胞治疗真正的突破,仍需要多方领域共同努力,不断完善更加高效、安全、适应性广泛的CAR-T细胞技术。 [1].Zhu, S., Phillips, D. J., Xu, X. (2020). Function and Application of Chimeric Antigen Receptor T Cells. Journal of hematology oncology, 13(1), 75. [2].Blanchard, M. S., Spiller, K. L., Lawrence, M., Brennan-Alvarado, E., Feasby, C., Kerr, E., McEachron, T. A., Morris, M. J., Roberts, D. W., Telting, M. K., Culbertson, C. T. (2020). Side effects of CAR T cell therapy. Cancer Metastasis Reviews, 39(2), 431-446. [3].Gardner, R. A., Ceppi, F., Rivers, J., Annesley, C., Summers, C., Taraseviciute, A., Gust, J., Leger, K. J., Scherer, L. J., Porter, D. L., Turtle, C. J. (2018). Preemptive mitigation of CD19 CAR T-cell cytokine release syndrome without attenuation of antileukemic efficacy. Blood, 132(6), 648-660. [4].Wang, Y., Hu, B., Xiong, X., Sun, Y., Chang, H., Xu, L., Phillips, D. J., Zhang, C. (2019). A systematic review of the safety and efficacy of mesenchymal stem cells for disc degeneration: insights and future directions for regenerative therapeutics. Stem cells and development, 28(8), 482-491. [5].Gardner, R. A., Finney, O., Annesley, C., Brakke, H., Summers, C., Leger, K., Bleakley, M., Brown, C., Mgebroff, S., Kelly-Spratt, K. S., Hoglund, V., Lindgren, C., Oronsky, B., Kislin, L., Venstrom, J. M., Goff, S. L., Lund, T. C., Li, D., … Jensen, M. C. (2016). Intent-to-treat leukemia remission by CD19 CAR T cells of defined formulation and dose in children and young adults. Blood, 127(26), 3322-3331.